|
Ett läkemedel i samma dos är inte detsamma för alla individer – vissa effektiva doser av läkemedlet kanske inte har en terapeutisk effekt på en annan, orsakar allvarliga biverkningar eller är livshotande. Upp till 20% av polikliniska patienter upplever biverkningar med medicinering, och 10-20% av slutenvårdspatienter upplever minst en biverkning under sjukhusvistelsen. Farmakogenetisk DNA-panel (DNA-Farmakogenetisk analys) gör det möjligt att studera patientens personliga genprofil och följaktligen att förskriva lämpliga läkemedel i rätt dos, vilket ökar sannolikheten för att behandlingen lyckas och minskar risken för farliga biverkningar eller ineffektiv behandling. |
 |
1. Genom att känna till patientens farmakogenetiska profil kan läkaren snabbt och exakt ordinera lämpligt läkemedel i en anpassad dos.
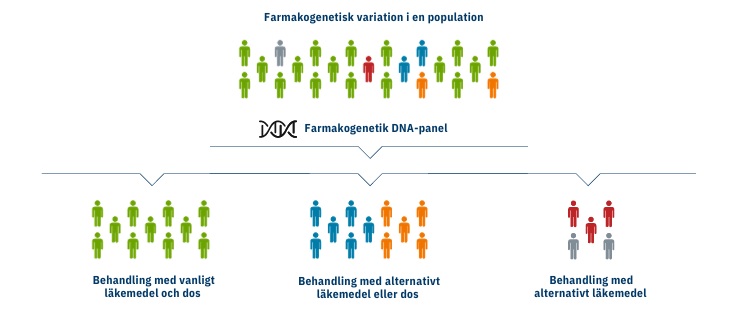
Farmakogenetik som hjälpmedel vid läkemedelsdosering bör övervägas inom alla medicinska specialiteter. Användningen av farmakogenetiska analyser är särskilt värdefull för följande läkemedel:
2. Kvaliteten på behandlingen förbättras och behandlingskostnaderna minskar
3. Farmakogenetiskt testade patienters fördelar och förbättringar:
4. Hos farmakogenetiskt testade patienter som använder flera läkemedel samtidigt observeras följande:
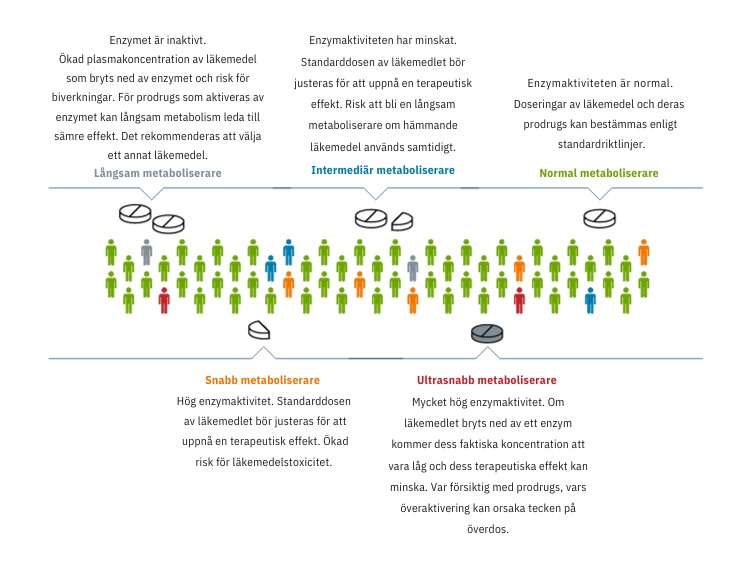
Panelen omfattar 29 gener relaterade till metabolismen av mer än 100 läkemedel.
| GEN |
FUNKTION |
| ABCB1 | Kodar för P-glykoprotein, ett viktigt cellmembrantransportprotein. P-glykoprotein kontrollerar inträdet av föreningar i cellen genom hela organismen, vilket påverkar koncentrationen av läkemedlet. |
| ABCB2 | Kodar för ett cellmembranprotein som transporterar flera molekyler, inklusive läkemedel, över membranet. ABCG2 transporterar en del av samma läkemedel som P-glykoprotein. |
| ALDH2 | Kodar för mitokondriellt aldehyddehydrogenas, som oxiderar aldehyder till motsvarande karboxylsyror. |
| BCHE | Kodar för ett ospecifikt butyrylkolinesteras som hydrolyserar olika kolinbaserade estrar. |
| CACNA1S | Kodar för alfa1S-subenheten av dihydropyridinreceptorn, som uttrycks i muskelcellernas sarkoplasmatiska retikulum och aktiverar kalciumkanalen RYR1 under membrandepolarisering i kontraktila myocyter. |
| CYP1A2 | Ett leverenzym som förmedlar metabolismen av flera läkemedel, koffein och procarcinogener. |
| CYP2B6 | Ett leverenzym som ansvarar för metabolismen av HIV och cancerläkemedel och bupropion. |
| CYP2C rs12777823 |
En genetisk variant associerad med lägre doser warfarin. |
| CYP2C19 | Ett leverenzym som förmedlar metabolismen av flera viktiga läkemedel, inklusive psykofarmaka, protonpumpshämmare och antikoagulantia. |
| CYP2C8 | Ett leverenzym som förmedlar metabolismen av flera läkemedel, inklusive antidiabetika, statiner, smärtstillande och cancerläkemedel. |
| CYP2C9 | Ett leverenzym som förmedlar metabolismen av flera läkemedel, inklusive warfarin och fenytoin. |
| CYP2D6 | Ett leverenzym som förmedlar metabolismen av cirka 20-25 % av de läkemedel som används, vilket inkluderar antidepressiva, antipsykotika, smärtstillande medel. |
| CYP3A4 | Ett leverenzym som förmedlar metabolismen av 30-50 % av de läkemedel som används. |
| CYP3A5 | Ett leverenzym som förmedlar metabolismen av flera läkemedel, varav den viktigaste är takrolimus. |
| CYP4F2 | Förmedlar metabolismen av olika endogena substrat och xenobiotika. Genotypinformation kan vara användbar, till exempel för att förutsäga dosen av warfarin. |
| DPYD | Kodar för dihydropyrimidindehydrogenas, som kataboliserar fluorpyrimidiner som används som kemoterapeutika vid olika typer av cancer. |
| F2 | Kodar för protrombin, som är ett av nyckelenzymerna i koagulationskaskaden. En mutation i protrombin-genen predisponerar för trombos. |
| F5 | Kodar koagulationsfaktorn faktor V. F5-genmutationen (så kallad Leiden-mutation) är den vanligaste mutationen som orsakar ärftlig trombos. |
| G6PD | Kodar för glukos-6-fosfatdehydrogenas, som skyddar erytrocyter från oxidativ stress. |
| GRIK 4 | Kodar för en kainatreceptor (glutamatreceptorsubtyp) som bidrar till glutamatergisk signalering. |
| IFNL3 | Kodar för interferon lambda 3, som utlöses av virusinfektioner. Varianter av denna gen hjälper till att utvärdera effektiviteten av hepatit C-behandling. |
| MTHFR | Kodar för metylentetrahydrofolatreduktasenzymet, som spelar en avgörande roll i folatmetabolism och påverkar metylerings- och DNA-syntesvägar. |
| NAT2 | Acetylerar och neutraliserar flera främmande föreningar. Aktiverar och producerar delvis vissa cancerframkallande ämnen, vars aktivitet kan vara relaterad till risken för cancer (t.ex. prostatacancer eller kolorektal cancer). |
| NFIB | Kodar för en transkriptionsfaktor som uttrycks i flera vävnader. Genen finns på den korta armen av kromosom 9. Kopieringsnummervarianter i denna region orsakar MACID-syndrom (makrocefali och intellektuell funktionsnedsättning), och varianter inom denna gen har associerats med klozapinmetabolism. |
| NUDT15 | Kodar för ett nukleosid-difosfatasenzym som omvandlar tiopurinläkemedelsmetaboliter till en mindre cytotoxisk form. |
| SLCO1B1 | Kodar för OATP1B1-proteinet, vilket underlättar leverupptaget av statiner från plasma. |
| TPMT | Kodar för tiopurinmetyltransferas, som är ansvarigt för metabolismen av tiopurinläkemedel. |
| UGT1A1 | Kodar för enzymet UDP-glukuronosyltransferas 1-1, som är ansvarigt för metabolismen av vissa läkemedel (t.ex. läkemedel mot cancer) och eliminering av bilirubin. |
| VKORC1 | Deltar i aktiveringen av koagulationsfaktorer och har ärftliga former som direkt påverkar doseringen av warfarin. |
Idag kräver farmakogenetisk analys ingen specifik föranalys eller speciell provtagning. Patient lämnar ett venöst blodprov vid någon av våra provtagningsplatser. Provet transporteras till laboratoriet, där analysen börjar.
Provtagning → DNA-isolering → OpenArray och CNV-analys → Tolkning
Genotypdata är organiserade efter gener. Flera medicinska specialister ansvarar för att informationen är korrekt och uppdaterad. Detta resulterar i en detaljerad rapport innehållande, förutom genspecifika resultat, en omfattande läkemedelsöversikt med doseringsrekommendationer och en sammanfattning av testade gener och predikterade fenotyper.
Generna som ingår i panelen är involverade i metabolismen av mer än 100 läkemedel relaterade till olika terapeutiska områden. Läkemedel grupperas baserat på resultat:
Rapporten lyfter också fram starkt påverkade läkemedel för olika terapeutiska områden med aktiv substans och fenotyp.
Läkemedellista för vilka den farmakogenetiska variationen påverkar läkemedelsresponsen eller biverkningar med viss eller signifikant klinisk relevans.
Varje läkemedel har läkemedelsspecifika doseringsrekommendationer baserade på vetenskapliga databaser (CPIC, etc.). Rekommendationerna är klassificerade baserat på läkemedlets säkerhet:
![]() Farmakogenetisk variation påverkar läkemedlets effektivitet eller biverkningar i kliniskt signifikant utsträckning. En genetisk analys rekommenderas. Innan du förskriver läkemedlet, kontrollera de tillgängliga testresultaten. Kontrollera doser och administrering baserat på testresultat.
Farmakogenetisk variation påverkar läkemedlets effektivitet eller biverkningar i kliniskt signifikant utsträckning. En genetisk analys rekommenderas. Innan du förskriver läkemedlet, kontrollera de tillgängliga testresultaten. Kontrollera doser och administrering baserat på testresultat.
![]() Farmakogenetisk variation påverkar läkemedlets effektivitet eller biverkningar, vilket har viss klinisk relevans. Om genetiska testresultat finns tillgängliga, överväg att justera mediciner eller doser baserat på resultat. Om genetisk testning inte har gjorts, överväg att beställa en.
Farmakogenetisk variation påverkar läkemedlets effektivitet eller biverkningar, vilket har viss klinisk relevans. Om genetiska testresultat finns tillgängliga, överväg att justera mediciner eller doser baserat på resultat. Om genetisk testning inte har gjorts, överväg att beställa en.
![]() Farmakogenetisk variation kan påverka läkemedlets effekt eller biverkningar, men detta är kliniskt oviktigt för de flesta patienter. Övervaka svar och möjliga biverkningar. Om genetiska testresultat finns tillgängliga, överväg att justera mediciner eller doser baserat på resultat.
Farmakogenetisk variation kan påverka läkemedlets effekt eller biverkningar, men detta är kliniskt oviktigt för de flesta patienter. Övervaka svar och möjliga biverkningar. Om genetiska testresultat finns tillgängliga, överväg att justera mediciner eller doser baserat på resultat.
![]() Farmakogenetisk variation påverkar inte läkemedlets effektivitet eller biverkningar signifikant.
Farmakogenetisk variation påverkar inte läkemedlets effektivitet eller biverkningar signifikant.
Farmakogenetisk DNA-panel är indicerad i följande fall:
Material & Provtagning: EDTA-blod
Förvaring: vid rumstemperatur 24h; vid 2-8 °C i max 5 dagar; vid längre tid måste provet förvaras fryst i -20 °C eller -80 °C.
Svarstid: ca 21 arbetsdagar
Pris: Vårdgivare: Kontakta kundtjänst, Patient: Kontakta din vårdgivare
Du hittar mer information om analysen i våra provtagningsanvisningar >>.
Farmakogenetisk DNA-panel kan beställas elektroniskt från de flesta journalsystemen eller med pappersremiss.
Den elektroniska remissen kan göras i journalsystemet
Saknar ditt journalsystem elektroniska möjligheter så går det bra att använda vår pappersremiss. I fältet "Önskade analyser..." anger du "DNA-Farmakogenetisk analys"
Du skickar provet till SYNLAB Täby med er vanliga transport. Vid behov av att skicka röret med post/speditör så måste det förvaras fryst.
Det går även bra att hänvisa patienten till våra Närlab för provtagning.
Svaret är så omfattande att det inte går att skicka elektroniskt. Som svar på analysen så kommer man att få en länk där man kan ladda ner den fullständiga rapporten.
Abomics
https://www.abomics.fi/en-gb/
Genomic Medicine Sweden (GMS) - Farmakogenetik
https://genomicmedicine.se/farmakogenomik/
https://nyheter.ki.se/patienter-kan-fa-30-procent-farre-biverkningar-med-genetisk-analys
CPIC guidelines
https://cpicpgx.org/guidelines/
Prioritization of CPIC Guidelines
https://cpicpgx.org/prioritization-of-cpic-guidelines/
KNMP pharmacogenetics
https://www.knmp.nl/dossiers/farmacogenetica/pharmacogenetics
Lähteenmäki, J. et al. (2023) Pharmacogenetics of warfarin and healthcare costs – Real-world data analysis. Pharmacoepidemiol Drug Saf. 32(3). 382-386. https://pubmed.ncbi.nlm.nih.gov/36524772/
Swen, J. J. et al. (2023) A 12-gene pharmacogenetic panel to prevent adverse drug reactions: an open-label, multicentre, controlled, cluster-randomised crossover implementation study. The Lancet. 401(10374), 347-356. https://doi.org/10.1016/S0140-6736(22)01841-4
Brown, L. C. et al. (2022). Pharmacogenomic Testing and Depressive Symptom Remission: A Systematic Review and Meta‐Analysis of Prospective, Controlled Clinical Trials. Clinical Pharmacology & Therapeutics. 112, 1303-1317. https://doi.org/10.1002/cpt.2748
Morris, S.A. et al. (2022) Cost Effectiveness of Pharmacogenetic Testing for Drugs with Clinical Pharmacogenetics Implementation Consortium (CPIC) Guidelines: A Systematic Review. Clin Pharmacol Ther. 112(6):1318-1328. https://pubmed.ncbi.nlm.nih.gov/36149409/
Eliasson, E., Wadelius, M. (2021) Farmakogenomik – individuell anpassning av läkemedel och dos [Pharmacogenomics - a cornerstone of Precision Medicine. Genomic Medicine Sweden analyses genotypes associated with serious drug toxicity or therapeutic failure]. Lakartidningen. 11; 118: 20176. https://lakartidningen.se/klinik-och-vetenskap-1/artiklar-1/temaartikel/2021/05/farmakogenomik-individuell-anpassning-av-lakemedel-och-dos/
Kauppila, M. et al. (2021) Incidence, preventability, and causality of adverse drug reactions at a university hospital emergency department. European Journal of Clinical Pharmacology. 77, 643-650. https://doi.org/10.1007/s00228-020-03043-3
Kheiri, B. et al. (2020) Genotype-Guided Strategy for P2Y12 Inhibitors in Coronary Artery Disease: A Meta-Analysis of Randomized Clinical Trials. J Am Coll Cardiol Intv. 13 (5) 659-661. https://doi.org/10.1016/j.jcin.2019.11.019
Perlis, R. et al. (2018) Pharmacogenetic testing among patients with mood and anxiety disorders is associated with decreased utilization and cost: A propensity-score matched study. Depression and Anxiety. 35(10), 946-952. https://doi.org/10.1002/da.22742
lliott, L. et al. (2017) Clinical impact of pharmacogenetic profiling with a clinical decision support tool in polypharmacy home health patients: A prospective pilot randomized controlled trial. PLOS ONE. 12(2), e017905. https://doi.org/10.1371/journal.pone.0170905
Ji, Y. et al. (2016) Preemptive Pharmacogenomic Testing for Precision Medicine: A Comprehensive Analysis of Five Actionable Pharmacogenomic Genes Using Next-Generation DNA Sequencing and a Customized CYP2D6 Genotyping Cascade. The Journal of molecular Diagnostics. 18(3), 438-445., 95(4), 423-432. https://doi.org/10.1016/j.jmoldx.2016.01.003